В химической науке существует множество веществ, которые проявляют уникальные свойства при взаимодействии с другими химическими элементами. Разнообразие взаимодействий и реакций, которые они способны вызывать, позволяют ученым классифицировать эти вещества и изучать их особенности в более подробном масштабе.
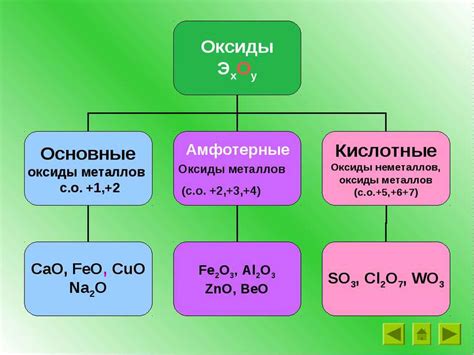
Одним из важных классов веществ являются амфотерные оксиды. Под этим термином понимаются соединения, которые обладают свойствами кислот и оснований одновременно. Интерес к этим соединениям неслучаен, так как они могут проявлять уникальные химические свойства, включающие изменение окислительного состояния и участие в катализе различных реакций.
Определение амфотерных оксидов является важным шагом в изучении их химической природы и способностей. Специалисты разрабатывают различные методы и подходы, которые позволяют определить амфотерность оксидов и выявить их уникальные химические свойства.
Различия между кислотными и щелочными оксидами
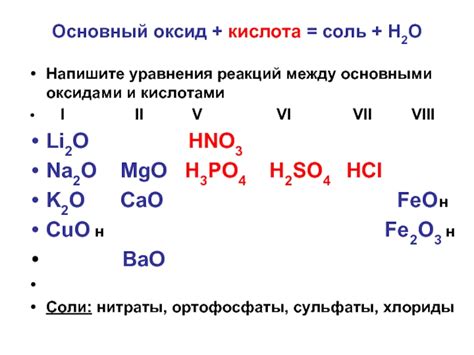
Кислотные оксиды, также известные как кислотные ангидриды, обычно образуются от неметаллических элементов. Они проявляют характеристики кислот, такие как сильное окислительное действие и способность реагировать с базами. Кроме того, они образуют кислотные растворы, когда реагируют с водой. Примерами кислотных оксидов являются диоксид серы (SO2) и диоксид азота (NO2).
С другой стороны, щелочные оксиды активно реагируют с кислородом и образуют основные растворы при смешивании с водой. Они обычно образуются от щелочных металлов, таких как натрий и калий, и проявляют щелочные свойства. Щелочные оксиды, такие как оксид натрия (Na2O) и оксид калия (K2O), также могут нейтрализовать кислотные соединения.
Таким образом, различия между кислотными и щелочными оксидами связаны с их свойствами и химическим поведением. Кислотные оксиды обладают кислотными характеристиками, реагируют с базами и формируют кислотные растворы в воде. С другой стороны, щелочные оксиды обладают щелочными свойствами и могут образовывать основные растворы. Понимание этих различий позволяет более глубоко изучать химические свойства оксидов и их взаимодействие с другими веществами.
Основные характеристики амфотерных оксидов

Первое значимое свойство амфотерных оксидов заключается в том, что они могут образовывать соли как с кислотными, так и с щелочными реагентами. Это говорит о том, что амфотерные оксиды способны выполнять роль и кислот и оснований в различных химических реакциях.
Второе характерное свойство амфотерных оксидов – это их способность реагировать с водой, образуя гидроксиды. При взаимодействии с водой амфотерные оксиды могут выделяться как кислотные и основные растворы, что свидетельствует опять же о их амфотерном характере.
Другое важное свойство амфотерных оксидов заключается в их способности образовывать амфотерные реакции. Такие реакции возникают, когда амфотерный оксид вступает в контакт с другими веществами, способными проявлять кислотные либо основные свойства. Благодаря этому, амфотерные оксиды играют важную роль в реакциях нейтрализации и стабилизации кислотно-щелочного баланса.
Основные характеристики амфотерных оксидов позволяют им выполнять разнообразные функции в химических процессах. Одно и то же соединение может вести себя как кислота или как основание, в зависимости от условий реакции и среды. Этот амфотерный характер делает амфотерные оксиды насыщенными и уникальными химическими веществами.
Химические свойства оксидов, обладающих амфотерными свойствами

Амфотерные оксиды представляют собой класс веществ, которые проявляют возможность взаимодействовать со средой как с кислотами, так и с щелочами. Они обладают непосредственной способностью взаимодействовать с разнообразными веществами, включая кислоты, основания и соли.
Химические свойства амфотерных оксидов проявляются в их способности образовывать соли как с кислотными, так и с щелочными компонентами. Такое взаимодействие результатом сложных реакций, в ходе которых происходит обмен протонами и ионы, что позволяет оксидам реагировать со средой и изменять свою структуру.
Пример амфотерного оксида Алюминиевый оксид (Al2O3), или оксид алюминия, является хорошо известным примером амфотерного оксида. Он способен взаимодействовать как с кислотами, выступая в роли основания, так и с щелочами, выступая в роли кислоты. Взаимодействие между алюминиевым оксидом и кислотой приводит к образованию солей и воды, в то время как реакция с щелочью приводит к образованию алюминатов и воды. |
Методы выявления способности оксидов проявлять амфотерные свойства

Методы определения амфотерности оксидов основаны на анализе их реакционной способности с различными веществами. Один из таких методов - экспериментальное изучение ионного состава раствора оксида при контакте с растворами кислот и щелочей. При этом образуются соответствующие соли и вода, и заряды ионов в реакционной среде позволяют определить амфотерные свойства оксида.
Еще одним методом является анализ поведения оксида в присутствии различных сильных оксидающих и восстановительных агентов. Амфотерные оксиды способны как окисляться, так и восстанавливаться в процессе химической реакции, что позволяет определить их амфотерные свойства.
Также для определения амфотерности оксидов можно использовать метод комплексообразования. Реакция оксида с соответствующими комплексообразователями позволяет выявить наличие и количество активных ионов оксида в растворе и, следовательно, определить его амфотерность.
Методы определения амфотерности оксидов играют важную роль в химических исследованиях, поскольку позволяют точно определить химические свойства и возможности реакции оксида с другими веществами. Это знание важно для таких областей, как производство материалов, катализ и экологическая химия.
Кислотно-щелочные реакции амфотерных оксидов

Различные вещества встречаются в природе в форме оксидов, которые могут обладать как кислотными, так и щелочными свойствами. Такие вещества называют амфотерными оксидами и они играют важную роль в химических реакциях.
Амфотерные оксиды способны проявлять как кислотные, так и щелочные свойства, что означает, что они могут быть ионизированы как в кислотные ионы, так и в щелочные ионы в среде с различной кислотно-щелочной средой. Таким образом, они могут реагировать как с кислотами, так и с основаниями.
В ходе кислотно-щелочных реакций амфотерные оксиды могут выступать в роли кислоты, отдавая протон основанию, или в роли основания, принимая протон от кислоты. Как в результате реакций с кислотами, так и с основаниями, образуются соли и вода.
Примером амфотерного оксида является оксид алюминия (Al2O3), который образуется при сгорании алюминия в кислороде. Когда оксид алюминия реагирует с кислотами, он проявляет свои щелочные свойства и образует соли. А при реакции с основаниями он проявляет свои кислотные свойства и образует соль и воду.
Таким образом, кислотно-щелочные реакции амфотерных оксидов показывают их способность взаимодействовать с кислотами и основаниями и образовывать соли и воду в процессе реакции.
Амфотерные оксиды в химии: разнообразные примеры
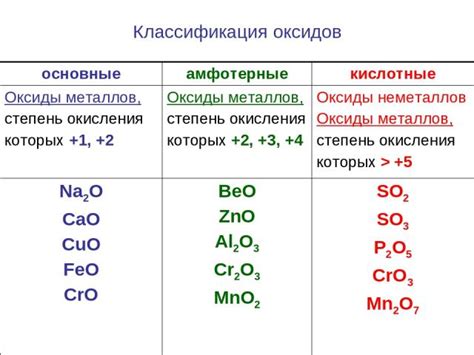
В химии существует большое разнообразие веществ, некоторые из которых обладают способностью проявлять амфотерные свойства. На практике это означает, что такие вещества могут реагировать как с кислотами, так и с щелочами в зависимости от условий. Другими словами, амфотерные оксиды могут выступать в реакциях ионами кислорода, проявлять кислотные свойства, а также принимать дополнительные атомы водорода, проявлять щелочные свойства.
Для наглядности приведем несколько примеров амфотерных оксидов:
- Алюминий оксид (Al2O3) - это один из популярных примеров амфотерного оксида. При реакции с кислотами алюминий оксид проявляет щелочные свойства и образует соли. В то же время он может реагировать с щелочами и образовывать алюминаты. Такое поведение делает его амфотерным оксидом.
- Свинцовая окись (PbO) - еще один пример амфотерного оксида. Она может взаимодействовать как с кислотами, так и с щелочами. При реакции с кислотами свинцовая окись образует соли, а с щелочами - гидроксид свинца.
- Цинковая окись (ZnO) - также является амфотерным оксидом. Она может образовывать соли с кислотами и гидроксид цинка с щелочами.
Таким образом, амфотерные оксиды представляют собой класс веществ, обладающих свойствами как кислот, так и щелочей. Эта способность делает их важными в химических реакциях и широко применяемыми в различных областях науки и промышленности.
Значение и применение амфотерных оксидов в промышленности
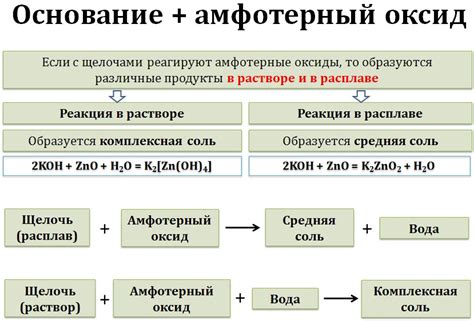
Одним из ключевых применений амфотерных оксидов является их использование в производстве керамики и стекла. Благодаря своей способности реагировать с кислотами и щелочами, они позволяют создавать прочные и долговечные материалы с разнообразными свойствами, от прозрачных и прочных стекол до керамических изделий с высоким уровнем термической стойкости.
Еще одной сферой применения амфотерных оксидов является производство металлов и сплавов. Они используются как промежуточные продукты в процессах получения различных металлов, например, алюминия и цинка. Амфотерные оксиды действуют как катализаторы в химических реакциях, облегчая процесс получения металлов с высокой степенью чистоты и качества.
Неотъемлемой частью производства электроники является использование амфотерных оксидов в производстве полупроводниковых материалов. Они выполняют роль субстратов для создания проводников, транзисторов и других элементов, обеспечивая их стабильность, электропроводность и долговечность.
Другим важным аспектом применения амфотерных оксидов в промышленности является их использование в производстве катализаторов. Благодаря своей способности взаимодействовать как с кислотами, так и с щелочами, они эффективно ускоряют химические реакции, позволяя снизить температуру и энергозатраты процессов синтеза, а также повысить выход продукта.
Таким образом, амфотерные оксиды играют важную роль в промышленности, обеспечивая создание прочных материалов, производство металлов, электроники и эффективных катализаторов. Их свойства и универсальность делают их незаменимыми компонентами во многих отраслях, способствуя развитию и совершенствованию технологий.
Важные свойства амфотерных оксидов в химических реакциях

Одним из важных свойств амфотерных оксидов является их способность реагировать как с кислотами, так и с основаниями. Это означает, что они могут принимать и отдавать протоны в реакциях. Подобная реакционная активность позволяет амфотерным оксидам участвовать в различных химических процессах и обладать широким спектром приложений.
| Свойство | Описание |
|---|---|
| Кислотное действие | Амфотерные оксиды могут реагировать с основаниями, образуя соли. Они проявляют кислотные свойства, когда вступают в реакцию с щелочными растворами или основаниями. |
| Основное действие | Взаимодействуя с кислотами, амфотерные оксиды образуют соли. Они проявляют основные свойства в реакциях с кислотами или кислотными растворами. |
| Амфотерность | Способность амфотерных оксидов проявлять как кислотные, так и основные свойства в различных реакциях. |
| Полная лигандная заместимость | Амфотерные оксиды могут образовывать соединения с различными лигандами, что расширяет возможности их применения в различных химических реакциях. |
Разносторонние свойства амфотерных оксидов дают им способность вести себя множеством различных способов в реакциях. Это позволяет их использовать в различных областях, от промышленности до лабораторной химии. Понимание этих свойств и их влияния на химические процессы является важным для разработки новых материалов и применения амфотерных оксидов в различных областях науки и промышленности.
Влияние pH на поведение оксидов с амфотерными свойствами
В данном разделе рассматривается важный аспект поведения оксидов, обладающих амфотерными свойствами, а именно их реакцию на изменение pH окружающей среды. Амфотерные оксиды способны проявлять как кислотные, так и основные свойства в зависимости от pH раствора или среды, в которой они находятся.
Изменение pH окружающей среды является ключевым фактором, влияющим на химическое поведение амфотерных оксидов. При нейтральном pH оксид может проявлять свои амфотерные свойства, т.е. показывать и кислотные, и основные реакции. В кислой среде оксид будет проявлять кислотные свойства, а в щелочной – основные.
Примерами амфотерных оксидов с различными реакциями на изменение pH окружающей среды являются оксиды нескольких химических элементов. Например, оксид алюминия (Al2O3) может реагировать как с кислотами, так и с щелочами в зависимости от pH. Это свойство находит применение, например, в процессе нейтрализации кислот или щелочей при обработке промышленных сточных вод.
- Оксид цинка (ZnO) также является амфотерным и его поведение зависит от pH. В кислой среде он может реагировать с кислотами, а в щелочной – с щелочами.
- Еще примером является оксид свинца (PbO), который обладает амфотерными свойствами и в разных pH реагирует по-разному.
Исследование и понимание влияния pH на поведение амфотерных оксидов имеет важное значение для широкого спектра областей, включая химическую промышленность, металлургию и экологию, где происходят процессы взаимодействия оксидов с другими веществами в различных pH условиях.
Вопрос-ответ

Что такое амфотерные оксиды?
Амфотерные оксиды - это соединения, которые могут реагировать с как кислотами, так и с щелочами. Они проявляют характеристики и кислот и оснований, поэтому могут проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции.
Какие методы используются для определения амфотерных оксидов?
Для определения амфотерных оксидов используются различные методы, включающие кислотно-основные титрации, измерение pH растворов с использованием электродов, определение степени растворимости в кислотах и щелочах, а также спектральные методы анализа.