Даже самая простая задача по распознаванию вещества может быть решена на основе его состава. И одним из ключевых элементов анализа являются кислотные остатки, на основе которых происходит их классификация. Такие остатки невидимы для простого глаза, но именно они способны подсказать, какие элементы включены в состав вещества. Что такое "кислотный остаток" и как он помогает нам разобраться в химическом строении веществ? Давайте вместе узнаем!
В химии каждое вещество имеет свой уникальный набор элементов, составляющих его структуру, которые как кирпичики в мозаике формируют его уникальные свойства. Однако, не всегда мы можем увидеть состав вещества непосредственно, особенно если оно находится в жидком или газообразном состоянии. В таких случаях мы полагаемся на результаты химических анализов, которые позволяют определить содержащиеся в веществе элементы и их количество. Именно здесь на помощь приходят так называемые "осадочные буквы" или кислотные остатки. Это группы атомов, связанные внутри молекулы, которые являются ключами к пониманию структуры вещества.
Какие же элементы могут быть представлены в виде кислотных остатков? Обратите внимание, что в химии используется множество терминов для обозначения подобных групп атомов в разных контекстах. Например, в одних случаях их называют "функциональными группами", в других - "структурными фрагментами", а в третьих - "химическими радикалами". Но независимо от названия, эти группы атомов выполняют одну и ту же функцию - они помогают идентифицировать наличие определенных элементов в составе вещества. Например, кислотные остатки с атомом кислорода обычно указывают на наличие в составе вещества элемента кислорода, а свободные щелочные радикалы свидетельствуют о наличии металлов.
Особенности понятия кислотного остатка в химических реакциях
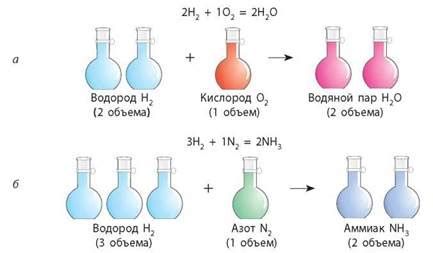
Кислотный остаток - это фрагмент молекулы, который остается после удаления всех водородных атомов из кислоты. Кислотный остаток может быть отрицательно заряженным и неразрывно связывается с положительно заряженными ионами в химической реакции. Таким образом, кислотный остаток является ключевым элементом при формировании солей и обладает специфическими свойствами.
Например:
Кислотный остаток серной кислоты (H2SO4) - SO42-. Он отрицательно заряжен и обладает способностью соединяться с положительными ионами, образуя соли, такие как сернокислые соли или сульфаты. Это объясняет, почему серная кислота является сильным кислотным соединением, способным реагировать с основаниями и металлами.
Кислотные остатки играют важную роль в химических реакциях, так как определяют свойства и способность веществ взаимодействовать с другими соединениями. Ученые используют знание о кислотных остатках, чтобы понять, какие реакции могут происходить между различными веществами и какие продукты образуются в результате таких реакций.
Какие характеристики присущи кислотным остаткам?
Первая характеристика – это кислотность, которая определяет способность кислотных остатков отдавать протоны. Протоны – это положительно заряженные частицы, и способность кислотных остатков отдавать их является основным признаком кислотности.
Вторая характеристика – это электроотрицательность. Кислотные остатки обладают высокой электроотрицательностью, что делает их способными привлекать электроны. Это является ключевым свойством, которое объясняет их активность и участие в реакциях.
Третья характеристика – это атомный радиус. Кислотные остатки сравнительно малы по размеру, что позволяет им образовывать эффективные связи с другими атомами в молекуле. Их малый радиус играет важную роль в стабильности и реакционной способности соединений, в которых они присутствуют.
И, наконец, четвертая характеристика – это способность кислотных остатков образовывать связи с другими элементами. Они могут образовывать как одноцентровые, так и многоцентровые связи, что обуславливает их разнообразные структуры и возможность образования различных типов соединений.
- Кислотность – выдача протона
- Электроотрицательность – притяжение электронов
- Атомный радиус – эффективное образование связей
- Способность образовывать связи – разнообразие структур
Применение кислотных остатков и их роль в химических соединениях
| Кислотный остаток | Роль в химических соединениях |
|---|---|
| Карбоксильная группа | Отвечает за кислотность соединения. Присутствует в органических кислотах, таких как уксусная и яблочная кислота. |
| Сульфатная группа | Формирует соли и эфиры, включая сульфаты металлов. Широко используется в промышленности и в производстве удобрений. |
| Нитратная группа | Присутствует в нитратах, используемых в производстве взрывчатых веществ и удобрений. |
| Фосфатная группа | Используется в фосфатах, играющих важную роль в метаболических процессах живых организмов, а также в производстве удобрений. |
Это лишь небольшой обзор примеров кислотных остатков, их разнообразие и роль в химических соединениях огромно. Понимание их свойств и функций позволяет ученым разрабатывать новые соединения с желаемыми свойствами и применениями.
Пояснение термина "кислотное соединение" и его связь с кислотными остатками
В химии существует такое понятие как "кислотное соединение", которое играет важную роль во многих химических процессах. Это вещество, которое образуется при реакции кислоты с другими веществами. Кислотное соединение содержит кислотные остатки, которые формируются при потере протона из кислоты и присоединении катиона или аниона.
Разберем это понятие подробнее. Когда кислота реагирует с основанием или металлическим оксидом, она теряет протон (H+). Оставшаяся часть кислоты, которая образуется после потери протона, называется кислотным остатком. Кислотный остаток может быть анионом или катионом, в зависимости от ситуации. Анионы кислотных остатков имеют отрицательный заряд, а катионы - положительный.
Примерами кислотных соединений являются многообразные вещества, которые мы встречаем в повседневной жизни. Например, серная кислота (H2SO4) образуется при реакции сероводорода (H2S) с кислородом (O2). При этой реакции кислотный остаток SO4^2- присоединяется к протону, образуя H2SO4.
Понимание понятия "кислотное соединение" и его связи с кислотными остатками важно для понимания реакций, происходящих в химических системах. Кислотные соединения имеют широкий спектр применения, как в промышленности, так и в быту. Изучение этих соединений помогает в понимании многих процессов, происходящих в нашей окружающей среде.
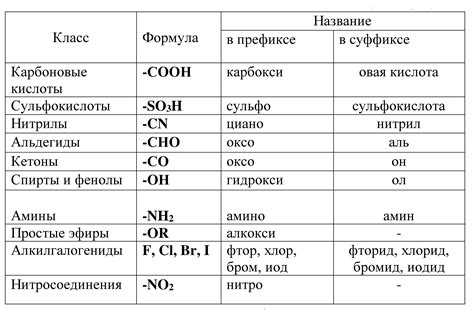
Влияние химических группировок на свойства веществ
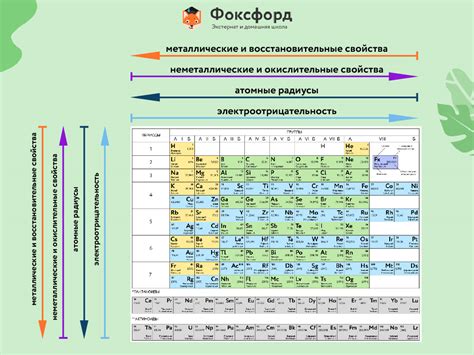
Одна из фундаментальных концепций в химии заключается в том, что химические группировки или функциональные группы, присутствующие в молекулах веществ, влияют на их свойства. Они определяют, как вещество будет взаимодействовать с другими веществами и какие физические и химические свойства оно будет обладать.
Химические группировки можно представить как "строительные блоки", из которых состоят молекулы. Каждая группировка имеет свою уникальную структуру и функцию, которая определяется типом атомов и их связей внутри группировки. Такие химические группировки могут быть найдены в различных классах органических и неорганических соединений.
| Химическая группировка | Примеры веществ | Влияние на свойства |
|---|---|---|
| Карбоксильная группа | уксусная кислота, масляная кислота | Увеличивает кислотность, повышает растворимость в воде |
| Гидроксильная группа | этанол, глицерин | Повышает растворимость в воде, обладает способностью образовывать водородные связи |
| Аминогруппа | аммиак, аминокислоты | Повышает основность, образует соли с кислотами |
Взаимодействие химических группировок определяет химическую активность вещества, его реакционную способность и возможность образования внутримолекулярных и межмолекулярных связей. Понимание влияния химических группировок на свойства веществ помогает химикам разрабатывать новые соединения с определенными свойствами и применением.
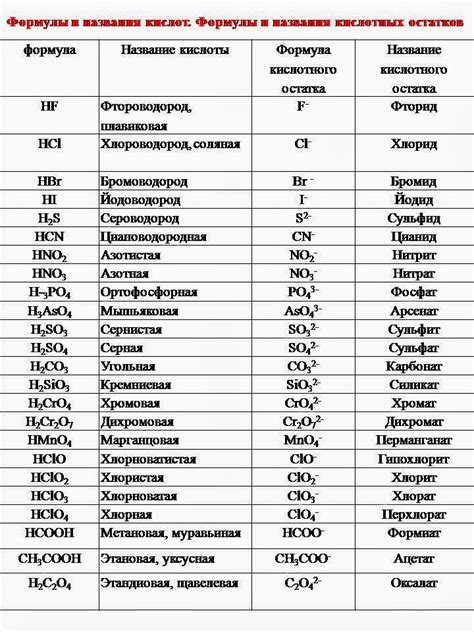
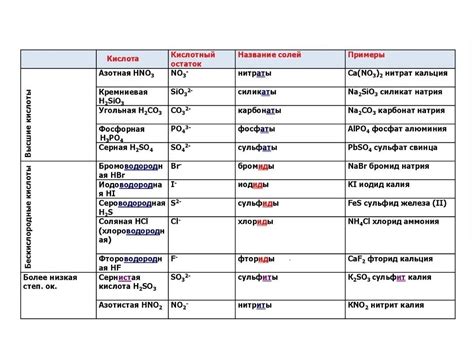
Классификация кислотных остатков в химических соединениях: виды и свойства
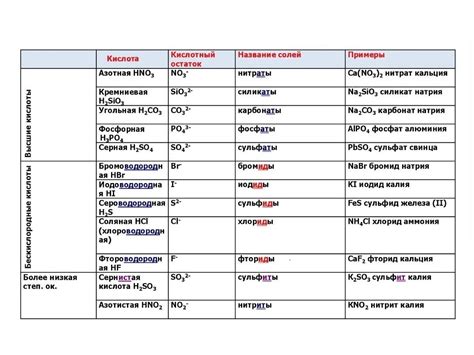
Одной из основных классификаций является разделение кислотных остатков на неорганические и органические. Неорганические кислотные остатки часто содержат атомы металлов и характеризуются особыми свойствами, в то время как органические кислотные остатки содержат атомы углерода и водорода и являются основными строительными блоками органических соединений.
Другой важной классификацией является разделение кислотных остатков на простые и сложные. Простые кислотные остатки состоят из одного атома или иона, например, гидроксидный остаток (OH-) или нитратный остаток (NO3-). Сложные кислотные остатки, например, сульфатный остаток (SO4-2), содержат несколько атомов ионов, связанных вместе.
Еще одной важной классификацией кислотных остатков является их степень окисления. Кислотные остатки могут иметь различные степени окисления, которые определяют их реакционную активность и способность участвовать в химических реакциях. Например, нитьянатный остаток (NO2-) имеет степень окисления +3, а нитратный остаток (NO3-) - +5.
Понимание классификации кислотных остатков помогает ученым анализировать и предсказывать свойства химических соединений. Знание свойств кислотных остатков позволяет лучше понять их влияние на реакционную активность и химическую стабильность соединений, а также способствует разработке новых материалов и прогнозированию их возможных применений.
Примеры из повседневной жизни, где кислотные остатки играют важную роль
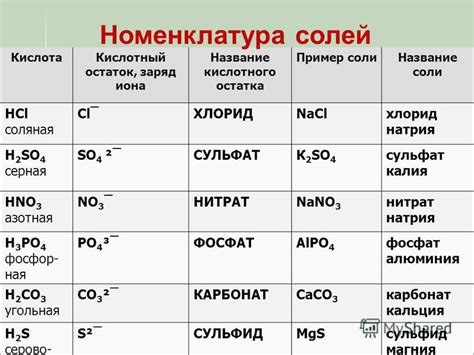
- В пищевой промышленности кислотные остатки используются для консервирования и маринования продуктов. Например, уксус является раствором уксусной кислоты, который используется для приготовления вкусных маринадов для огурцов или мяса. Кислотность помогает сохранить продукты в свежем состоянии на длительное время.
- В медицине кислотные остатки используются для процедур дезинфекции и стерилизации. Например, перекись водорода, которая содержит перекись кислорода, используется для обработки ран и ушибов. Она способна уничтожить бактерии и предотвратить инфекцию.
- В бытовых условиях мы также сталкиваемся с использованием кислотных остатков. Например, в бытовой химии используются кислоты для очистки поверхностей от накипи, ржавчины и других загрязнений. Кислотность позволяет быстро и эффективно справиться с грязью и восстановить чистоту.
- В промышленности кислотные остатки применяются в различных процессах, таких как производство удобрений или очистка воды. Например, серная кислота используется в процессе получения фосфорных удобрений, которые являются важным компонентом для выращивания растений.
Это лишь некоторые примеры использования кислотных остатков в нашей жизни. Они демонстрируют, как данное понятие применяется в разных областях и как его использование способствует улучшению и оптимизации различных процессов.
Важность изучения кислотных остатков в химии для учеников восьмого класса
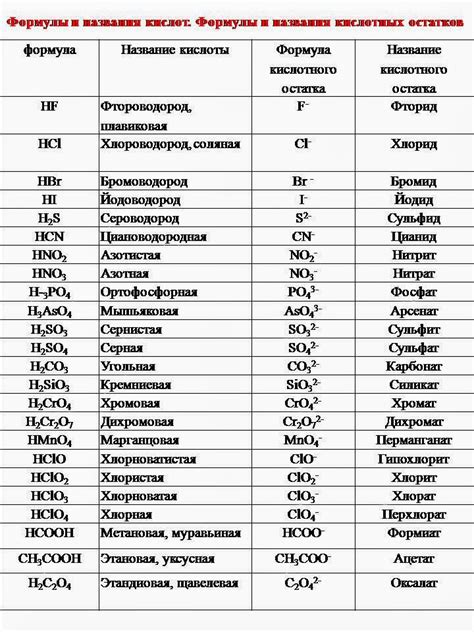
Понимание кислотных остатков в химии имеет значительное значение для обучающихся восьмого класса. Изучение этих понятий позволяет ученикам расширить свои знания о химических соединениях и взаимодействии веществ, а также углубить свою эрудицию в области естествознания.
Познание кислотных остатков помогает ученикам увидеть, как с помощью соединений веществ можно получить разнообразные реакции и продукты. Овладение этим знанием позволяет обучающимся более точно предсказывать результаты различных химических экспериментов и лучше понимать взаимодействие веществ в естественной и искусственной среде.
Изучение кислотных остатков также помогает ученикам расширить свой словарный запас в области химии и научиться использовать термины и понятия в своей речи и письменных работах. Улучшение словарного запаса улучшает коммуникацию и обмен знаниями и позволяет ученикам точнее и яснее выражать свои мысли в области химии.
Более глубокое понимание кислотных остатков также может быть полезным при изучении более сложных понятий в химии, таких как кислотно-основное равновесие и химические реакции, проводимые в растворах. Разбираясь в основных принципах кислотных остатков, ученики могут лучше понять эти концепции и быть лучше подготовленными к изучению материала на более глубоком уровне.
Изучение кислотных остатков в химии не только развивает учеников как обучаемых, но и развивает их как активных и критически мыслящих граждан. Понимание состава и взаимодействия химических соединений имеет практическое применение в повседневной жизни, а также может быть полезно в различных научных, технических и медицинских областях.
Изучение кислотных остатков в химии для учеников восьмого класса является важным шагом в их познавательном и научном пути, позволяя им расширить свои знания, развить аналитическое мышление и лучше понять мир химических соединений.
Применение знания о кислотных химических соединениях в реальной жизни
Узнавание и понимание кислотных химических соединений, которые встречаются в нашей жизни, позволяет нам лучше понять и объяснить многие ежедневные процессы. Наша повседневная жизнь полна примеров, где знание о кислотных остатках может быть полезным.
Один из самых распространенных примеров применения кислотных остатков - это использование антиацидных препаратов для снятия изжоги и уменьшения кислотности в желудке. Знание о кислотных соединениях позволяет определить, какой именно антиацидный препарат будет эффективным в конкретной ситуации.
| Пример | Применение знания о кислотных остатках |
|---|---|
| Покраска металлических поверхностей | Выбор правильного кислотного раствора для очистки и обработки поверхности перед покраской, чтобы обеспечить лучшую адгезию краски и защиту от коррозии. |
| Консервирование пищевых продуктов | Использование кислотных соединений, таких как лимонная кислота, уксусная кислота или аскорбиновая кислота, для создания кислой среды, которая препятствует развитию бактерий и гниения продуктов. |
| Очистка домашних поверхностей | Использование кислотных средств, например, уксуса или лимонного сока, для удаления накипи, известковых отложений и других загрязнений с поверхностей в доме. |
| Производство удобрений | Использование кислотных соединений, например, серной кислоты или фосфорной кислоты, в процессе производства удобрений для обеспечения необходимых питательных веществ растениям. |
Также, понимание кислотных соединений может помочь нам разобраться в процессах, происходящих в нашем организме. Знание о кислотности крови и pH-уровнях помогает в диагностике и лечении определенных заболеваний, таких как ацидоз или алкалоз.
Вопрос-ответ

Что такое кислотный остаток?
Кислотный остаток – это ион, образующийся в результате отщепления одной или нескольких протонов от кислоты.
Какие примеры кислотных остатков существуют?
Примеры кислотных остатков включают сульфатный ион (SO4^2-), нитратный ион (NO3^-), уксусный ион (CH3COO^-) и многие другие.
Какие важные свойства имеют кислотные остатки?
Кислотные остатки являются амфотерными, то есть они могут проявлять кислотные или щелочные свойства в зависимости от условий реакции. Они также обладают отрицательным зарядом и способны образовывать соли.
Каким образом кислотные остатки влияют на свойства кислот и щелочей?
Кислотные остатки определяют свойства кислот, так как они являются основной частью молекулы кислоты. Когда кислотный остаток отщепляется от кислоты, остающаяся часть образует щелочной остаток, который определяет свойства щелочей.
Какие примеры химических соединений могут образовываться при реакции кислотных остатков с основанием?
При реакции кислотных остатков с основанием могут образовываться соли. Например, при реакции сульфатного иона (SO4^2-) с натриевым гидроксидом (NaOH) образуется сульфат натрия (Na2SO4).
Что такое кислотный остаток в химии?
Кислотный остаток - это ион или молекула, который остается после того, как от кислоты отщепляется один или несколько протонов.



