Один из самых удивительных процессов, лежащих в основе многих индустриальных отраслей, а также научных исследований, – это техника электролиза. Она направляет силу электричества в управляемый поток, превращая обычные химические реакции в нечто невероятное и инновационное. Благодаря своей необычной способности изменять физические и химические свойства веществ, процесс электролиза позволяет нам изучать и использовать на практике многочисленные материалы и соединения.
Суть электролиза заключается в том, что электрический ток проводится через жидкий или расплавленный состав, называемый электролитом. При этом происходит разложение электролита на его составные части – ионы – под воздействием электрического тока. Получившееся разделение ионов полностью меняет физические и химические свойства вещества, позволяя использовать электролиз в разнообразных областях.
Одной из ключевых областей применения электролиза является электрохимия. С помощью этой техники исследователи могут получать и изучать различные реакции, в том числе электродные, а также измерять и контролировать параметры электролитов и других веществ. Кроме того, электролиз находит широкое применение в области серийного производства определенных химических соединений, таких как хлор и щелочи, а также металлов, включая алюминий, медь и никель, позволяя экономить ресурсы и сокращать вредные вещества, выбрасываемые в окружающую среду.
Вместе с тем, возможности электролиза не ограничиваются только исследованиями и промышленными процессами. Он также находит применение в производстве горючего водорода и кислорода, используемых в топливных элементах. Некоторые исследования даже свидетельствуют о возможности применения электролиза для утилизации отходов и очистки воды, что делает его незаменимым инструментом в реализации экологически устойчивых технологий.
Основы электролиза и его применение в промышленности

Одной из важных областей применения электролиза является гальваническое покрытие, которое используется для нанесения тонких слоев металлов на поверхности различных материалов. Благодаря электролизу можно создавать защитные покрытия, повышать эстетические свойства изделий, а также улучшать их характеристики, обеспечивая повышенную стойкость к коррозии и износу.
Другой важной областью, где находит применение электролиз, является химическая промышленность. С помощью этого процесса можно получать различные химические элементы и соединения, используемые в производстве лекарств, удобрений, красителей и многих других химических продуктов. Электролиз позволяет эффективно и экономически выгодно осуществлять разнообразные химические реакции.
Кроме того, электролиз используется в процессе производства алюминия. Этот металл является одним из самых распространенных в мире и широко применяется в различных областях, включая авиацию, строительство и электротехнику. Электролизная методика позволяет получать алюминий из его природных руд, что делает его производство энергоэффективным и экологически устойчивым.
Таким образом, электролиз, основанный на принципе разложения веществ под действием электрического тока, находит широкое применение в промышленности. Этот процесс используется для создания покрытий, получения химических элементов и соединений, а также производства алюминия. Благодаря электролизу достигаются значительные результаты в области защиты, химии и металлургии.
Электролитическое разложение вещества под воздействием электрического тока

Главная идея электролиза заключается в том, что когда ток проходит через электролитическую ячейку, происходит перемещение заряженных частиц - ионов - под действием электрического поля. Это приводит к разделению вещества на его составляющие элементы или ионы. При этом, положительно заряженные ионы - катионы - движутся к аноду, а отрицательно заряженные ионы - анионы - движутся к катоду.
Таким образом, электролиз позволяет не только разлагать вещества на ионы, но и контролировать направление движения заряженных частиц с помощью выбора анода и катода. Это открывает широкие возможности для применения электролиза в различных областях. Например, в химической промышленности электролиз используется для получения металлов, производства химических веществ и электролитического получения водорода и кислорода для использования в различных процессах.
Кроме того, электролиз играет важную роль в оксидационно-восстановительных процессах, в гальванических батареях и аккумуляторах, а также в проведении электрохимических анализов. Все это делает электролиз незаменимым инструментом как в научных исследованиях, так и в промышленности.
Высокая вариабельность применения электролиза: множество способов получения металлов, проведение химических синтезов и очистка воды
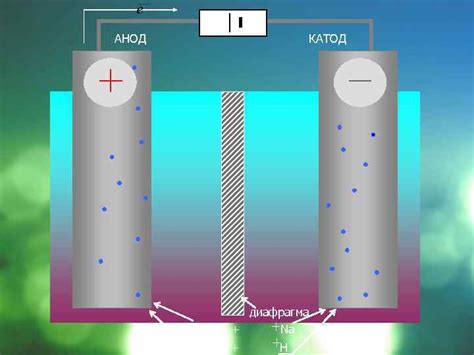
С одной стороны, электролиз используется в металлургии для получения металлов различных видов. Это означает, что благодаря электролизу возможно получение меди, цинка, свинца, никеля и других металлов, которые широко применяются в различных отраслях промышленности.
Но это далеко не все применения электролиза: он также находит применение в сфере химических синтезов. Электролиз позволяет производить электрохимическое взаимодействие различных веществ, что открывает огромные возможности для получения новых химических соединений и веществ. Благодаря электролизу можно проводить синтез органических соединений, полимеров, карбонатов и многих других веществ, которые используются в промышленности и научных исследованиях.
Очистка воды – еще одна важная область применения электролиза. Благодаря электролизу возможно эффективно очистить воду от загрязнений, таких как различные тяжелые металлы, органические вещества, соли и другие примеси. Этот процесс не только позволяет получать очищенную воду для различных нужд, но и играет важную роль в сохранении окружающей среды и предотвращении загрязнений окружающих водных ресурсов.
Вопрос-ответ

Как работает процесс электролиза?
Процесс электролиза основан на разложении вещества на составляющие его компоненты при прохождении электрического тока через него. В зависимости от свойств вещества, происходит растворение или выделение вещества на электродах.
Какие вещества могут быть подвергнуты электролизу?
Подвергнуться электролизу могут различные вещества, как металлические соединения, так и кислоты, щелочи и соли. Возможность электролиза зависит от степени их реактивности и проводимости.
Какие устройства используются для проведения электролиза?
Для проведения электролиза используются специальные устройства, называемые электролизерами или электролизными ячейками. Они состоят из двух электродов, которые погружены в электролит (воду или раствор вещества) и соединены с источником постоянного тока.
Какие области применения имеет электролиз?
Электролиз имеет широкую область применения. Он используется в процессах производства металлов, получении хлора, очистке и дизинфекции воды, производстве водорода и кислорода, синтезе органических соединений и других отраслях промышленности.
Каковы основные преимущества и недостатки электролиза?
Основными преимуществами электролиза являются высокая чистота получаемых продуктов, возможность управления процессом и экономичность в сравнении с другими методами. Однако, недостатками являются высокая энергозатратность и сложность масштабирования процесса.
Какой принцип работы электролиза?
Электролиз - это процесс, основанный на применении электрического тока для разложения химических веществ на ионы. При этом положительно заряженные ионы (катионы) притягиваются к отрицательному электроду (катоду), а отрицательно заряженные ионы (анионы) - к положительному электроду (аноду). Под действием электрического тока происходят реакции окисления и восстановления веществ, что позволяет получать различные продукты.



