Устройство и функции белков
Все организмы, начиная от простейших животных и заканчивая человеком, базируются на белках - универсальных молекулярных агентах, которые обеспечивают нормальное функционирование клеток и тканей. Белки выполняют множество важных функций в организме: от транспортировки кислорода и питательных веществ до регуляции генетической активности. Ключевую роль в определении характеристик и функций каждого белка играет его уникальная структура.
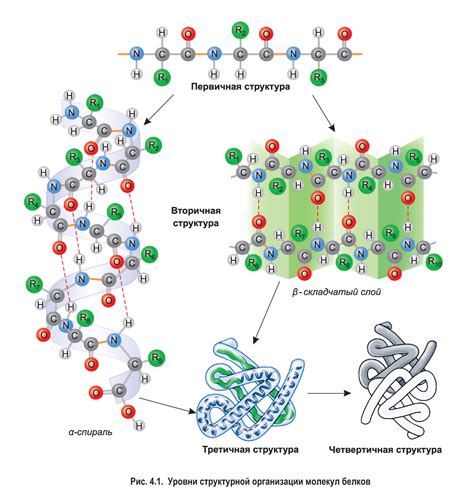
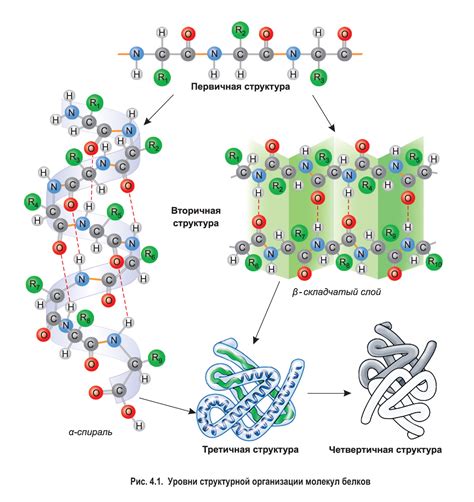
Первичная структура: основа белковой молекулы
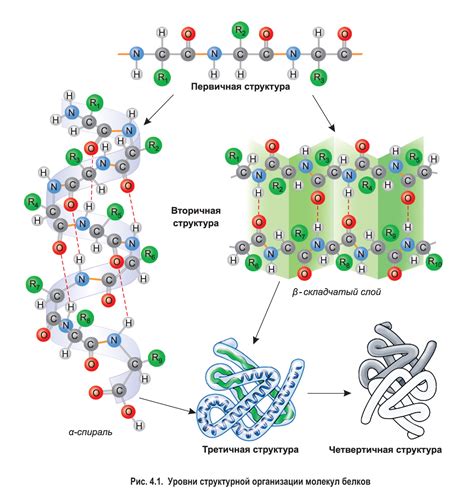
Первичная структура белка представляет собой последовательность аминокислот - строительных блоков, из которых он состоит. Правильная последовательность аминокислот в молекуле задает формирование белка в трехмерное волчанку, обеспечивая его функциональность. Однако, первичная структура сама по себе не может обеспечить полноценное функционирование белка без формирования вторичной структуры.
Вторичная структура белка: принципы формирования
Вторичная структура белка представляет собой пространственное расположение основных элементов пространственной организации - α-спиралей и β-складок. Эти элементы формируются в результате взаимодействия аминокислот и образуют локальные участки молекулы с определенными пространственными углами. Вторичная структура белка немыслима без важного фактора - противостоящих сил: водородных связей и водородного связывания между собой аминокислотных остатков.
Влияние разнообразных элементов на формирование вторичной структуры белка
При обсуждении формирования вторичной структуры белка необходимо учитывать множество факторов, оказывающих влияние на этот процесс. Эти элементы обладают значимостью в формировании пространственной организации белковой молекулы.
Интеракции водородной связи – один из ключевых факторов, влияющих на стабильность вторичной структуры белков. Водородные связи формируются между атомами аминокислотных остатков и направлены таким образом, чтобы минимизировать энергетические затраты системы.
Гидрофобные взаимодействия – еще один важный фактор, который влияет на формирование вторичной структуры белка. Аминокислотные остатки, содержащие гидрофобные цепочки, стремятся собраться внутрь молекулы и избегать контакта с водой, что способствует стабильности вторичной структуры.
Электростатические взаимодействия – также играют важную роль в формировании вторичной структуры белка. Заряженные аминокислотные остатки могут привлекать или отталкивать друг друга, что ведет к различным вариациям вторичной структуры.
Факторы окружающей среды такие как pH и температура также оказывают свое влияние на формирование вторичной структуры белка. Изменения в окружающей среде могут вызывать деградацию или наоборот, стабилизацию вторичной структуры белковой молекулы.
Таким образом, формирование вторичной структуры белка зависит от широкого спектра факторов, взаимодействующих между собой и влияющих на множество аспектов этого процесса. Понимание этих факторов помогает в раскрытии механизмов формирования и стабильности вторичной структуры белков и является важным шагом в исследованиях наук о жизни и медицине.
Роль аминокислотного состава в формировании вторичной структуры белков
Каждая аминокислота обладает своими химическими свойствами, такими как положительный или отрицательный заряд, гидрофобность или гидрофильность, способность к образованию водородных связей и др. Эти химические свойства определяют взаимодействия аминокислот внутри белка и влияют на его пространственную конформацию.
К примеру, аминокислоты с положительным зарядом (лизин, аргинин) и аминокислоты с отрицательным зарядом (глутамат, аспартат) могут образовывать солены и ионо-дипольные взаимодействия, которые могут стабилизировать вторичную структуру белка, такие как α-спираль или β-складки.
- Водородные связи, которые образуются между аминокислотами, также играют важную роль в формировании вторичной структуры белка. Например, внутренние водородные связи могут способствовать формированию α-спиральных участков в белке.
- Гидрофобные аминокислоты, такие как валин или изолейцин, обладают большой гидрофобностью и играют важную роль в формировании гидрофобного ядра внутри белка, что способствует его стабильности и корректной свертке.
- Также, аминокислотный состав может влиять на функциональные свойства белка. Например, белки, содержащие аминокислоты серин или треонин, могут подвергаться фосфорилированию, что может изменять их активность или взаимодействие с другими молекулярными компонентами.
Таким образом, аминокислотный состав белка играет важную роль в формировании его вторичной структуры, определяя его пространственную конформацию, стабильность и функциональные свойства. Изучение этих влияний помогает нам лучше понять механизмы работы белков и их роль в живых организмах.
Влияние физических параметров на устойчивость вторичной пространственной конформации протеина
Физические параметры оказывают значительное влияние на стабильность вторичной структуры белка, играя важную роль в поддержании его оптимальной конформации. Вторичная структура, такая как α-спираль, β-складка или β-извитый лист, обуславливает специфические физико-химические свойства протеина и его функциональную активность.
Температура является одним из ключевых параметров, оказывающих влияние на стабильность вторичной структуры белка. Повышение температуры может привести к нарушению водородных связей между аминокислотными остатками, что может привести к разрушению вторичной структуры. С другой стороны, низкие температуры могут приводить к увеличению числа водородных связей и, тем самым, способствовать формированию более стабильной вторичной структуры.
Воздействие механических сил также оказывает существенное влияние на стабильность вторичной структуры белка. Механическое растяжение или сжатие протеина может изменить пространственное расположение аминокислотных остатков, нарушить водородные связи и вызвать изменение вторичной структуры. Это может приводить к дисфункции протеина или даже его денатурации.
Параметры pH оказывают значительное влияние на устойчивость вторичной структуры белка. Зависимость структуры белка от pH обусловлена изменением заряда аминокислотных остатков, что влияет на образование водородных связей и электростатических взаимодействий между ними. В результате изменения pH белок может переходить из своей нативной вторичной структуры в другую конформацию, что приводит к изменению его функции.
Таким образом, физические параметры, такие как температура, механические силы и параметры pH, имеют важное значение для стабильности вторичной структуры белка, и их оптимальное сочетание необходимо для поддержания его функциональности.
Значимость водородных связей в процессе становления характерной вторичной архитектуры белка
В процессе формирования определенной вторичной структуры белка, ключевую роль играют водородные связи. Эти слабые химические взаимодействия особенно важны для организации устойчивой пространственной конформации и влияют на свойства белковых структур.
Водородные связи возникают между атомами водорода и атомами кислорода, азота или серы, а также между атомами этих атомов и водорода. Они образуются благодаря разнице электроотрицательности атомов, которая позволяет образованию диполя. Возникновение водородных связей определяется как внутримолекулярными, так и межмолекулярными факторами. Возможность образования водородных связей усиливается благодаря правильной конформации, взаимному расположению атомов и доступности акцепторных и донорных групп.
| Роль водородных связей | Значение |
|---|---|
| Стабилизация вторичной структуры | Водородные связи предотвращают перемещение атомов внутри белковой цепи, способствуя формированию пространственной конформации и местами необходимой локализации. |
| Поддержание требуемых угловых позиций | Водородные связи участвуют в поддержании специфических угловых позиций в вторичной структуре, таких как α-спираль или β-складка, что определяет особенности пространственного размещения аминокислотных остатков. |
| Влияние на стабильность белка | Водородные связи содействуют межмолекулярной устойчивости белка, участвуя в формировании более высоких уровней его структуры, таких как третичная и кватерническая. |
| Регулирование функциональности | Водородные связи могут влиять на возможность белка взаимодействовать с другими молекулами и ферментами, определяя его функциональность и активность. |
Таким образом, понимание значения водородных связей в процессе формирования вторичной структуры белка является ключевым для понимания исходной пространственной организации и функциональности белковых молекул.
Взаимодействие боковых цепей аминокислот при формировании вторичной структуры белка
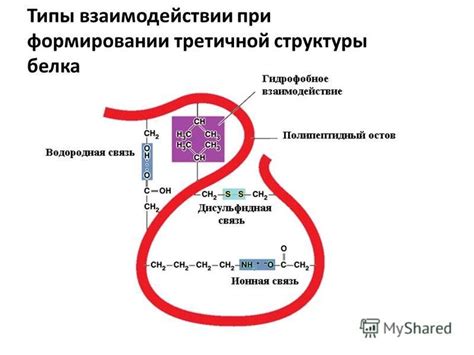
Воздействие боковых цепей аминокислот на процесс формирования вторичной структуры белка играет определяющую роль в определении его пространственной конформации. Взаимодействия между боковыми цепями аминокислот могут быть явными или скрытыми, но в любом случае они подразумевают под собой перемещение и взаимодействие атомов в молекуле белка.
Наличие различных функциональных групп в боковых цепях аминокислот, таких как ароматические кольца, карбоксильные и аминогруппы, способствует возникновению различных типов взаимодействий. Эти взаимодействия включают гидрофобное взаимодействие, водородные связи, сольватационные эффекты и пространственные электростатические взаимодействия. Они важны для формирования элементов вторичной структуры, таких как α-спирали и β-листы.
Гидрофобное взаимодействие играет ключевую роль в формировании вторичной структуры белка. Оно основано на химической аффинности гидрофобных аминокислот к воздуху или гидрофобным растворителям, что приводит к их скоплению внутри белковой молекулы. Это создает гидрофобный ядро, вокруг которого формируются другие элементы вторичной структуры. Водородные связи, сольватационные эффекты и электростатические взаимодействия могут дополнительно укреплять структуру и определять ее стабильность.
Важно отметить, что конкретное взаимодействие боковых цепей аминокислот зависит от их последовательности в цепочке белка. Структура и расположение аминокислот определяют доступность отдельных боковых цепей для взаимодействия и формирования пространственной конформации белка. Это подчеркивает важность последовательности аминокислотной цепи в процессе формирования вторичной структуры белка и определения его функции.
Роль пространственной организации в процессе формирования вторичной структуры белка
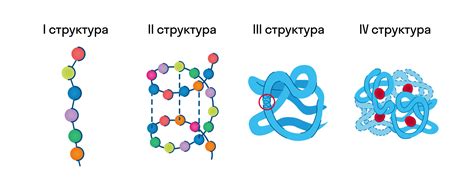
Вторичная структура белка представляет собой упорядоченное сочетание протяженных элементов молекулы, таких как альфа-спирали и бета-складки. Эти элементы возникают благодаря внутренним взаимодействиям между аминокислотными остатками и могут быть описаны в терминах геометрических параметров, таких как углы поворота и расстояния между атомами.
Пространственная организация белка является результатом сложного взаимодействия гидрофобных, электростатических и ван-дер-Ваальсовых взаимодействий между атомами молекулы. Пространственная организация влияет на формирование вторичной структуры белка, поскольку определяет доступность аминокислотных остатков для взаимодействий и их возможное пространственное расположение.
Пространственная организация белка также играет важную роль в процессе складывания молекулы. Правильная организация атомов позволяет белку принимать определенные конформации, которые обеспечивают его функциональность. Деформации в пространственной организации могут привести к нарушению вторичной структуры и функциональности белка, что может вызывать различные патологии и заболевания.
Итак, пространственная организация играет ключевую роль в формировании вторичной структуры белка. Ее влияние на геометрические параметры и взаимодействия аминокислотных остатков определяет стабильность и функциональность молекулы. Понимание этой роли является важным шагом в изучении и разработке новых методов в биохимии и молекулярной биологии.
Влияние взаимодействий гидрофобных и гидрофильных групп на формирование вторичной структуры белков
Гидрофобные группы обладают значительной неполярностью и предпочтительно находятся внутри белка, подальше от водной среды. Они стремятся кластеризоваться, чтобы максимально уменьшить контакт с водой. В то же время, гидрофильные группы обладают полярными свойствами и способны взаимодействовать с водой. Взаимодействие между гидрофобными и гидрофильными группами происходит через различные типы связей, включая водородные связи, электростатическое взаимодействие и ван-дер-ваальсовы силы.
Взаимодействия гидрофобных и гидрофильных групп играют ключевую роль в формировании вторичной структуры белков. Например, образование α-спиралей происходит благодаря взаимодействию гидрофобных боковых цепей аминокислот с окружающими гидрофобными группами. Эти элементы вторичной структуры образуют стабильные участки белка и способствуют его складыванию в трехмерную конформацию. Аналогично, образование β-складок также основано на взаимодействии гидрофобных и гидрофильных групп, где гидрофильные группы образуют лицевую сторону структуры, а гидрофобные группы образуют сердцевину.
Таким образом, взаимодействие между гидрофобными и гидрофильными группами является важным фактором, определяющим формирование вторичной структуры белков. Это взаимодействие обеспечивает стабильность и пространственную организацию белка, играя решающую роль в его функциональности и способности выполнять свои биологические функции.
Значимость электростатических взаимодействий в формировании вторичной структуры белка
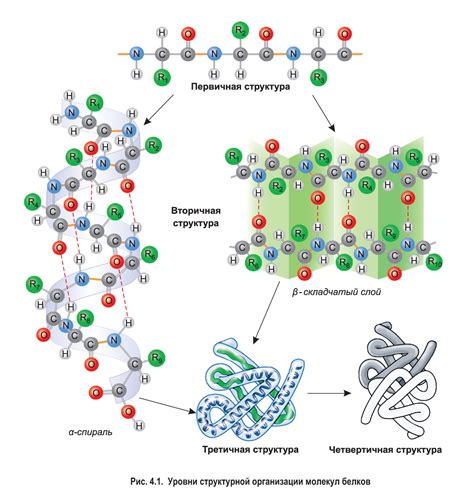
Электростатические взаимодействия играют существенную роль в процессе формирования вторичной структуры белка. Они представляют собой взаимодействия между электрически заряженными атомами или группами атомов, которые имеют положительный или отрицательный заряд.
- Взаимодействия между заряженными аминокислотными остатками внутри полипептидной цепи могут стабилизировать спиральные α-геликсы или листовые β-складки. Полное согласование по зарядам приводит к формированию стабильных электростатических взаимодействий, которые являются ключевыми для стабилизации вторичной структуры.
- Некоторые аминокислотные остатки могут образовывать заряженные центры, которые притягивают другие группы атомов с противоположным зарядом. Это создает дополнительные электростатические связи, способствующие формированию устойчивых вторичных структур.
- Ориентация заряженных остатков может создавать дипольные электрические поля, которые влияют на взаимодействия с соседними остатками и стабилизируют вторичную структуру белка.
- Электростатические взаимодействия также могут влиять на то, как белок связывается с другими молекулами, такими как лиганды или другие белки. Они могут модулировать активность белка или его способность взаимодействовать с другими биомолекулами.
Таким образом, электростатические взаимодействия имеют значимое значение для формирования структуры белка, определяя его вторичную структуру и способность к взаимодействию с другими молекулами. Понимание этих взаимодействий является ключевым фактором в изучении структуры и функции белков, а также в разработке новых лекарственных препаратов и других биотехнологических приложений.
Роль внешних условий в формировании и укреплении вторичной конформации белков
- Влияние температуры. Изменение температурных условий может привести к нарушению стабильности вторичной структуры белка. В зависимости от вида белка, оптимальная температура для его стабильности может различаться.
- Возможное влияние pH-уровня. Кислотность или щелочность окружающей среды может оказывать влияние на формирование и стабильность вторичной конформации белка. К примеру, изменение pH может привести к изменению заряда аминокислотных остатков, что, в свою очередь, может изменить взаимодействие с другими частями белка.
- Роль ионов. Присутствие или отсутствие определенных ионов в окружающей среде может влиять на вторичную структуру белка. Отсутствие определенных ионов может вызывать изменение электростатических взаимодействий внутри структуры, что может повлечь изменение ее пространственной конформации.
- Влияние растворителей. Растворители, такие как вода или органические растворители, могут влиять на формирование и стабильность вторичной структуры белка. Полярные растворители, например, вода, могут усиливать водородные связи, что способствует образованию белковых спиралей и прочным структурам внутри белковых цепей.
Таким образом, внешние условия, такие как температура, pH-уровень, присутствие ионов и растворителей, играют важную роль в формировании и стабилизации вторичной структуры белков. Понимание этих факторов является ключевым для изучения и модификации белковых структур в контексте различных биологических процессов и медицинских исследований.
Особенности формирования вторичной структуры в различных типах белков
- Роль аминокислотных последовательностей
- Укладка протеиновой цепочки
- Водородные связи
- Гидрофобные взаимодействия
- Примеры специфичных вторичных структур
Аминокислотные последовательности в белках обладают значительной гибкостью и способностью к образованию различных структурных мотивов. Исследования показывают, что определенные последовательности аминокислот могут быть склонны к образованию спиральных или прямолинейных структур вторичной структуры.
Процесс укладки протеиновой цепочки является ключевым для формирования вторичной структуры белка. Благодаря термодинамическим и кинетическим факторам, молекулы белка принимают определенную пространственную конформацию, что позволяет формированию вторичной структуры.
Водородные связи играют важную роль в формировании вторичной структуры белка. Эти слабые взаимодействия между атомами водорода и электроноакцепторами способствуют стабилизации спиралей (α-геликсы) и прямолинейных участков (β-складки).
Гидрофобные взаимодействия возникают между неполярными аминокислотами, а также между гидрофобными участками молекулы белка и окружающей средой. Эти взаимодействия играют важную роль в формировании структуры белка и способствуют его устойчивости.
В различных типах белков можно наблюдать наличие специфичных вторичных структур, таких как α-геликсы, β-складки, β-витки и другие. Они имеют свои особенности и выполняют различные функции в организме.
Взаимодействие вторичной структуры белка с другими молекулами и их роль
В данном разделе мы рассмотрим важное взаимодействие, которое осуществляет вторичная структура белка с различными молекулами, а также их значимую роль в функционировании организма.
- Взаимодействие с лигандами: вторичная структура белка способна образовывать специфические связи с различными молекулами, такими как ионы, газы, аминокислоты и другие органические соединения. Эти взаимодействия играют важную роль в катализе реакций, регуляции генов и сигнальных каскадах.
- Взаимодействие с другими белками: вторичные структуры могут образовывать соединения с другими белками, образуя множество молекулярных комплексов. Такие комплексы могут быть ответственными за выполнение различных функций, включая транспорт веществ, связывание гормонов и передачу сигналов в клетке.
- Взаимодействие с мембранами: типичной особенностью вторичной структуры белка является ее способность встраиваться в липидные двойные слои, которые образуют клеточные мембраны. Такая взаимосвязь позволяет белку выполнять функции, связанные с передачей сигналов через клеточные мембраны, транспортом веществ и участием в регуляции клеточных процессов.
Взаимодействие вторичной структуры белка с другими молекулами играет важную роль в поддержании жизнедеятельности организма. Эти взаимодействия обеспечивают стабильность и функциональность белков, а также регулируют множество клеточных процессов. Понимание этих взаимодействий позволяет разрабатывать новые методы лечения различных заболеваний и создавать новые функциональные материалы на основе белков.
Вопрос-ответ

Что такое вторичная структура белка?
Вторичная структура белка - это упорядоченное пространственное расположение аминокислот внутри полипептидной цепи белка. Она определяется особым порядком связей между атомами, который образует устойчивые элементы структуры, такие как α-спираль, β-складка и другие.
Какие факторы определяют формирование вторичной структуры белка?
Формирование вторичной структуры белка зависит от нескольких ключевых факторов. Один из таких факторов - это последовательность аминокислот в цепи белка. Расположение различных аминокислот может способствовать формированию определенных пространственных конформаций. Кроме того, вторичная структура может определяться физико-химическими свойствами аминокислот, такими как заряд, размер и гидрофобность. Также влияние на формирование вторичной структуры оказывают условия окружающей среды, включая температуру, pH и взаимодействия с другими молекулами.
Почему вторичная структура белка имеет такое важное значение?
Вторичная структура белка играет важную роль в его функционировании. Она обеспечивает устойчивость полипептидной цепи белка, образуя протяженные устойчивые элементы. Это позволяет белку выполнять свою функцию, например, связываться с другими молекулами или принимать участие в метаболических реакциях. Кроме того, вторичная структура белка может определять его свойства, такие как устойчивость к ферментативному распаду или способность свертываться в трехмерную структуру.



