Успешная сдача ОГЭ по химии – важный этап в жизни многих школьников. Данный предмет, как и другие на экзамене, требует тренировки и грамотного подхода к подготовке. Но что нужно знать, чтобы успешно пройти этот экзамен?
Химия – наука, изучающая строение, свойства и превращения веществ. Это предмет, который ставит своими учебными целями не только усвоение базовых знаний, но и развитие логического мышления и умения анализировать информацию. Программа ОГЭ по химии включает в себя не только теоретические знания, но и практическую составляющую, которая проверяется на экзамене.
Готовиться к ОГЭ по химии нужно комплексно. Вам потребуется изучение теоретического материала, решение типовых задач, выполнение экспериментов и их анализ, а также проверка своих знаний с помощью специальных задач на закрепление. Дополнительно, стоит не забывать о регулярной самопроверке и решении задач разных уровней сложности. Все это поможет вам не только подготовиться к экзамену, но и лучше разобраться в принципах и закономерностях, на которых основывается химическая наука.
Важные основы органической химии

В данном разделе мы рассмотрим основные концепции и принципы органической химии, которые необходимы для успешной подготовки к ОГЭ по данному предмету.
Органическая химия является разделом химии, который изучает вещества, состоящие в основном из углерода. Она является чрезвычайно важной и широко применяемой в нашей повседневной жизни, так как большинство органических соединений являются основой для различных материалов, лекарств, пищевых продуктов и т.д.
В процессе изучения органической химии стоит ознакомиться с такими ключевыми понятиями, как функциональные группы (группы атомов, определяющие свойства органических соединений), степень окисления (показатель электронного состояния атомов в молекуле), изомерия (феномен, при котором молекулы имеют одинаковый химический состав, но различную структуру) и реакции органического синтеза (превращения одного органического соединения в другое).
Понимание этих основных принципов и понятий позволит вам разобраться в многообразии органических соединений, их свойствах и взаимодействиях. Используя эти знания, вы сможете легко анализировать и решать задачи, связанные с органической химией на ОГЭ и в дальнейшем образовании.
Неорганическая химия: основные классы соединений

| Класс соединений | Описание | Примеры |
|---|---|---|
| Кислоты | Неорганические кислоты – это соединения, содержащие в своей структуре один или несколько водородных атомов, которые могут образовывать ион H+ при взаимодействии с водой. Кислоты широко используются в промышленности и науке, а также являются важными для живых организмов. | Соляная кислота (HCl), серная кислота (H2SO4) |
| Основания | Основания – это соединения, которые образуют ионы OH- при реакции с водой. Они часто используются в бытовых и промышленных целях, а также являются важными в биологических процессах. | Гидроксид натрия (NaOH), гидроксид аммония (NH4OH) |
| Соли | Соли – это соединения, которые образуются при реакции кислот и оснований. Соли широко используются в быту, промышленности и агропромышленности, а также играют важную роль в биологических системах. | Хлорид натрия (NaCl), сульфат магния (MgSO4) |
| Оксиды | Оксиды – это соединения, состоящие из атома кислорода и другого элемента. Они являются важными в промышленности и науке, а также играют ключевую роль в геохимических процессах и в атмосфере. | Оксид алюминия (Al2O3), оксид кальция (CaO) |
Это лишь некоторые из основных классов соединений, которые изучаются в неорганической химии. Каждый класс соединений отличается своими уникальными свойствами и имеет важное применение в различных сферах жизни. Понимание основных классов соединений поможет не только в изучении химии, но и в понимании многих процессов, происходящих в мире веществ.
Физическая химия: законы и явления

В этом разделе мы рассмотрим основные законы и явления, которые изучаются в физической химии. Мы поговорим о принципах, которыми руководствуются вещества при взаимодействии, и о тех явлениях, которые происходят на молекулярном и атомном уровне.
| Закон или явление | Описание |
|---|---|
| Закон Дальтона | Постулат, утверждающий, что смеси газов состоят из отдельных частиц, называемых молекулами, которые не подвергаются химическим превращениям при смешении. |
| Закон Гей-Люссака | Закон, определяющий пропорциональность объема газа и его температуры при постоянном давлении. |
| Закон Генри | Связь между содержанием газа в жидкости и его парциальным давлением, выражаемая пропорциональностью. |
| Явление катализа | Процесс, при котором специальное вещество, называемое катализатором, ускоряет химическую реакцию, не участвуя в ней самостоятельно. |
| Явление диффузии | Процесс перемешивания молекул одного вещества с молекулами другого в результате их теплового движения. |
Физическая химия изучает законы и явления, связанные с физическими свойствами и состоянием веществ. Она позволяет нам понять, как происходят реакции и превращения веществ, а также как контролировать их процессы. Знание законов и явлений физической химии поможет вам лучше понять мир вокруг нас и успешно справиться с заданиями на ОГЭ по химии.
Химические реакции: разновидности и механизмы
Живое и неживое: различия в химических реакциях
Химические реакции могут происходить как в организмах, так и в неживых системах. Однако, природа этих процессов может существенно различаться. В организмах, например, происходят биохимические реакции, которые связаны с обменом веществ и поддержанием жизнедеятельности. В неживых системах, химические реакции могут быть вызваны различными факторами, такими как температура, давление, состав реагентов и т.д.
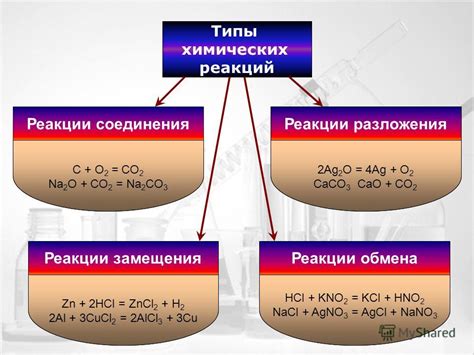
Виды химических реакций
Химические реакции могут быть разделены на несколько основных типов в зависимости от их характеристик и протекания. Некоторые реакции могут происходить с выделением тепла, другие могут требовать поглощения энергии. Одни реакции происходят быстро и сопровождаются образованием газов, другие могут быть более медленными и не приводить к выделению видимых продуктов. Важно понимать, что каждый тип реакции имеет свои особенности и механизмы протекания.
Анализ и углубление в понимание химических реакций поможет укрепить основы химии и приготовиться к успешной сдаче ОГЭ по данному предмету.
Атомная структура и расположение элементов в периодической системе
Раздел "Атомная структура и периодическая таблица" представляет собой важный компонент изучения химии. В этом разделе мы сосредоточимся на атомной структуре и на расположении элементов в периодической системе. Разберем, как атомы организованы, какие у них основные части и как они взаимодействуют между собой.
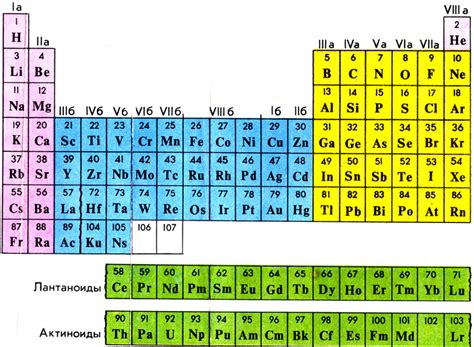
В основе понимания атомной структуры лежит модель атома, которая описывает его состав и структуру. Мы рассмотрим атомы как минимальные единицы вещества и выясним, что их составляют ядро и электроны. Научимся понимать, как распределены электроны вокруг ядра и как эти свойства влияют на химические реакции и свойства веществ. Изучение атомной структуры поможет нам также понять, каким образом различные элементы могут образовывать соединения и сочетания.
Для упорядочения и классификации элементов в химии используется периодическая система. Мы изучим историю создания периодической таблицы и ее современное форматирование. Изучение периодической таблицы поможет нам определить место каждого элемента и узнать его химические свойства и характеристики. Также мы разберемся в системе нумерации элементов, их периодах и группах, а также важных закономерностях, которые можно выделить в периодической системе.
Растворы и их особенности

В данном разделе будут рассмотрены растворы и их характеристики, а также их общие свойства и влияние на реакции и процессы в химических системах.
Растворы – это гомогенные системы, образованные при смешении двух или более веществ, где одно вещество распределено равномерно в другом. Важно понимать, что растворы включают не только жидкости, но и газы и даже твёрдые вещества.
Одной из основных характеристик растворов является их концентрация, которая может быть выражена различными способами, например, в молях, процентах или долях. Концентрация раствора имеет важное значение для определения его физических и химических свойств.
Растворы также обладают определенными физическими и химическими свойствами: вязкостью, плотностью, теплопроводностью, распределением тепла и проводимостью. Понимание этих свойств поможет в дальнейшем анализе и изучении реакций и процессов в растворах.
В заключении, раздел "Растворы и их свойства" позволит более глубоко понять особенности растворов, их влияние на химические реакции и процессы, а также научиться анализировать и оценивать химические системы с использованием этих знаний.
Электрохимия: изучение гальванических элементов и их роль в химических процессах
В рамках изучения предмета химия, одна из ключевых тем, которую необходимо освоить, это электрохимия и гальванические элементы. Эта наука занимается изучением взаимосвязи между электрическими и химическими явлениями. Она помогает понять, как происходят различные химические реакции, связанные с передачей электронов.
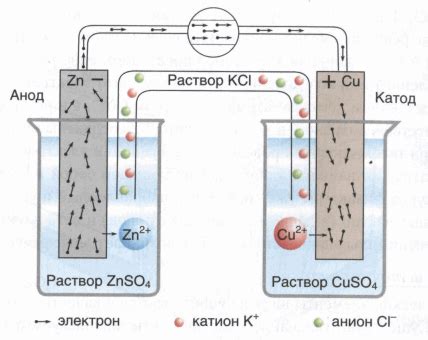
Гальванический элемент – это устройство, в котором происходит превращение химической энергии в электрическую. Он состоит из двух электродов, погруженных в электролит и соединенных внешней цепью. Когда происходит химическая реакция, в результате которой происходит передача электронов, возникает электрический ток.
Электрохимические реакции могут быть разными – от простых взаимодействий металлов с кислотами до сложных процессов, таких как электролиз. Изучение электрохимии помогает объяснить такие явления, как ржавление металлов, электродвижущие силы, окислительно-восстановительные реакции и другие.
Кроме того, изучение электрохимии имеет важное практическое значение. Гальванические элементы используются в различных устройствах и системах, включая батарейки, аккумуляторы, солнечные панели и другие энергетические источники. Понимание принципов работы гальванических элементов позволяет создавать более эффективные и экологичные способы получения и хранения энергии.
Равновесие в химической системе

Равновесие в химической системе означает, что скорость протекания прямой реакции равна скорости протекания обратной реакции. В таком случае концентрации веществ, участвующих в реакции, остаются постоянными. Равновесие может быть динамическим, когда обе реакции протекают одновременно, либо статическим, когда все реакции прекращаются полностью.
В химических системах равновесие может быть сдвинуто вправо или влево. Если равновесие сдвинуто вправо, то концентрации продуктов реакции больше, чем концентрации исходных веществ. Если равновесие сдвинуто влево, то концентрации исходных веществ преобладают над концентрациями продуктов.
- Термодинамическое равновесие. Подразумевает отсутствие изменений в энергии и температуре в системе в течение длительного времени.
- Химическое равновесие. Описывает состояние системы, в котором концентрации веществ остаются постоянными со временем.
- Фазовое равновесие. характеризует распределение фаз в системе и отражает состояние, при котором концентрации веществ в каждой фазе не изменяются.
Равновесие в химической системе является основополагающим понятием в химии и изучается в различных областях, включая физическую и органическую химию. Знание основ равновесия позволяет анализировать и предсказывать химические реакции, а также контролировать их условия с целью получения желаемых продуктов.
Закономерности и связи в химических процессах

Одной из ключевых закономерностей в химии является закон сохранения массы, согласно которому воздействие на химическую систему не может привести к изменению ее массы. С этой закономерностью связаны такие понятия, как стехиометрия и реакционные уравнения. Стехиометрия изучает соотношение количества веществ в реакциях, а реакционные уравнения позволяют записать превращение веществ в виде химической формулы.
Помимо закона сохранения массы, в химических процессах проявляются и другие закономерности и связи. Например, закон сохранения энергии показывает, что энергия не может создаваться или уничтожаться, а только преобразовываться. Этот закон связан с такими понятиями, как экзотермические и эндотермические реакции, в которых происходит выделение или поглощение энергии соответственно.
Еще одним важным аспектом химических процессов является закон соответственных пропорций. Этот закон показывает, что в реакциях вещества реагируют в определенных пропорциях, и изменение этих пропорций может привести к изменению результата реакции. С данным законом связаны такие понятия, как эмпирическая формула, которая показывает отношение между атомами различных элементов в веществе, и стехиометрический коэффициент, который отражает их количественное соотношение в реакции.
Вопрос-ответ

Какие предметы нужно брать на ОГЭ по химии?
На ОГЭ по химии необходимо брать следующие предметы: учебник по химии, тетрадь для записей, пишущие принадлежности (ручки, карандаши, ластик), калькулятор (если его разрешено использовать).
Можно ли использовать калькулятор на ОГЭ по химии?
Использование калькулятора на ОГЭ по химии разрешено, однако стоит уточнить данную информацию у преподавателя или в официальных источниках.
Можно ли брать шпаргалки на ОГЭ по химии?
На ОГЭ по химии использование шпаргалок запрещено. Вам следует полагаться только на знания, полученные в процессе обучения.
Какие еще материалы могут понадобиться на ОГЭ по химии, кроме учебника?
Помимо учебника по химии, вам могут понадобиться задания и материалы для самостоятельных и контрольных работ, карточки с формулами и терминами, справочные таблицы и фото таблиц с химическими элементами, атласы и схемы химических реакций.



